○宮崎大学医学部附属病院医薬品等の製造販売後調査に関する規程
平成16年4月1日
制定
第1章 総則
(目的)
第1条 この規程は、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(昭和35年法律第145号。以下「薬機法」という。)、医薬品、医療機器の品質、有効性及び安全性の確保等に関する法律施行規則(昭和36年厚生省令第1号。以下「薬機法施行規則」という。)、医薬品の製造販売後の調査及び試験の実施の基準に関する省令(平成16年厚生労働省令第171号。以下「省令第171号」という。)、医療機器の製造販売後の調査及び試験の実施の基準に関する省令(平成17年厚生労働省令第38号。以下「省令第38号」という。)、再生医療等製品の製造販売後の調査及び試験の実施の基準に関する省令(平成26年厚生労働省令第90号。以下「省令第90号」という。)及び宮崎大学受託研究取扱規程(平成16年4月1日施行)に基づき宮崎大学医学部附属病院(以下「本院」という。)における医薬品、医療機器又は再生医療等製品(以下「医薬品等」という。)の製造販売後調査に関し、必要な事項を定め、製造販売後調査が倫理的な配慮の下に、科学的に適正に実施されることを目的とする。
(定義)
第2条 この規程において用いる用語の意義は、次の各号に定めるもののほか、薬機法、薬機法施行規則、省令第171号、省令第38号及び省令第90号の規定による。
(1) 「製造販売後調査」とは、薬機法、薬機法施行規則、省令第171号、省令第38号及び省令第90号に規定する製造販売業者等が医薬品等の品質、有効性及び安全性に関する情報の収集、検出、確認又は検証のために行う一般使用成績調査、特定使用成績調査及び使用成績比較調査をいう。
(2) 「一般使用成績調査」とは、日常の診療における医薬品の使用実態下において、医薬品を使用する患者の条件を定めることなく、副作用による疾病等の種類別の発現状況など適正使用情報の把握のために行う調査(第4号に規定する使用成績比較調査に該当するものを除く。)をいう。
(3) 「特定使用成績調査」とは、小児、高齢者、妊産婦、腎機能障害又は肝機能障害を有する患者、医薬品を長期に使用する患者その他の医薬品を使用する条件が定められた患者における副作用等による疾病等の種類別の発現状況並びに品質、有効性及び安全性に関する情報の検出又は確認を行う調査(第4号に規定する使用成績比較調査に該当するものを除く。)をいう。
(4) 「使用成績比較調査」とは、特定の医薬品を使用する患者の情報と当該医薬品を使用しない患者の情報とを比較することによって行う調査をいう。
(5) 「本院採用医薬品」とは、本院において処方、施用が認められた製造販売後医薬品をいう。
(6) 「製造販売後調査医薬品等」とは、製造販売後調査の対象とされる医薬品等をいう。
(7) 「製造販売後調査責任医師」とは、本院において製造販売後調査に係る業務を統括する者で助教以上の医師又は歯科医師をいう。
(8) 「製造販売後調査分担医師」とは、本院において、製造販売後調査責任医師の指導の下に製造販売後調査に係る業務を分担する医師又は歯科医師をいう。
(9) 「調査対象者」とは、製造販売後調査の対象となる者をいう。
(10) 「製造販売後調査依頼者」とは、製造販売後調査の依頼をしようとする者をいう。
(11) 「製造販売後調査実施計画書」とは、製造販売後調査の実施前に作成された製造販売後調査の目的、対象、方法等に関する実施計画書をいう。
(12) 「有害事象」とは、製造販売後調査医薬品等を投与された調査対象者に生じた全ての疾病又はその徴候をいう。
(受入の原則)
第3条 医薬品等の製造販売後調査は、業務に支障を来すおそれがないと認められる場合であって、本院採用医薬品等に限り受け入れるものとする。
(記録の保存)
第4条 製造販売後調査に関する次に掲げる記録等は、別に定めのあるもののほか、医薬品等の再審査及び再評価が終了した日から5年間適切に保存するものとする。
(1) 診療に関する記録、製造販売後調査責任医師等の変更に関する確認書
(2) 製造販売後調査医薬品等の使用記録
(3) 製造販売後調査申請書、審査委員会に関する記録
(4) 契約に関する記録
(記録の保存責任者)
第4条の2 病院長は、医療機関において保存すべき必須文書の保存責任者を指名するものとする。
2 文書・記録ごとに定める保存責任者は次のとおりとする。
(1) 診療に関する記録:病院情報システム運用推進会議議長
(2) 製造販売後調査受託に関する文書等(契約関連):管理課長
(3) 製造販売後調査受託に関する文書等(契約関連を除く。):臨床研究支援センター治験部門長
3 前項の保存責任者は、別に定める製造販売後調査医薬品等の審査機関(以下「治験審査委員会」という。)から調査の求めがあった場合は、全ての記録等を直接閲覧に供しなければならない。
第2章 製造販売後調査等
(製造販売後調査の受入申請)
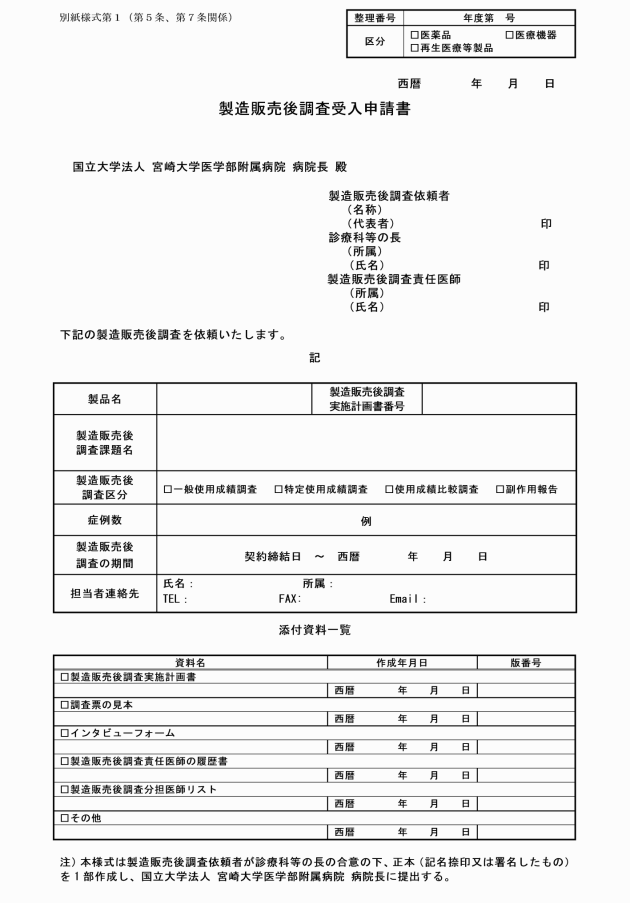
第5条 製造販売後調査依頼者は、製造販売後調査を依頼する製造販売後調査責任医師及び製造販売後調査責任医師の所属する診療科又は中央診療施設等の長(以下「診療科等の長」という。)の合意の下、製造販売後調査受入申請書(別紙様式第1)を作成し、臨床研究支援センター治験部門を経由して病院長に提出しなければならない。
(製造販売後調査の変更申請)
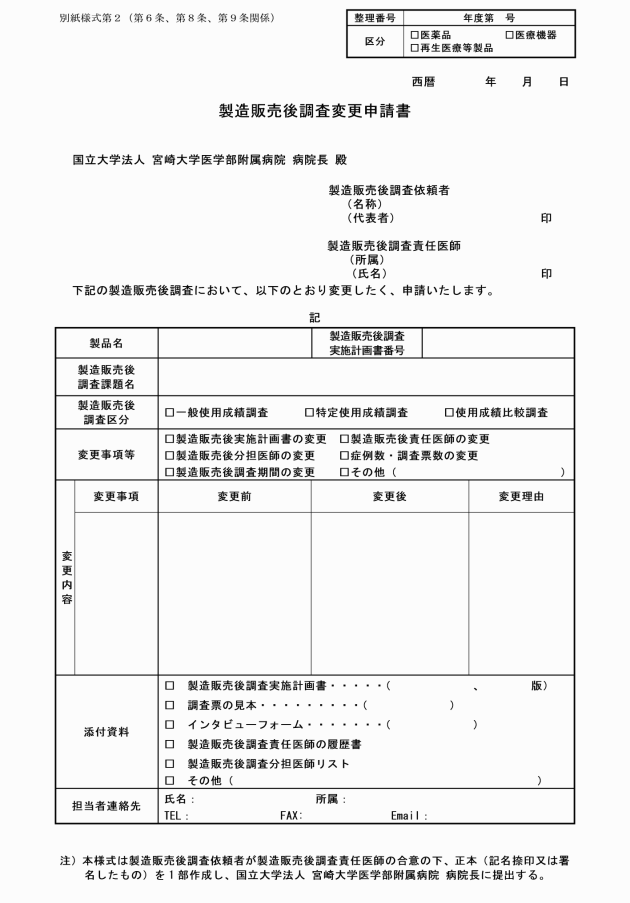
第6条 製造販売後調査依頼者は、製造販売後調査計画書の重大な変更をしようとする時は、製造販売後調査責任医師の合意の下、製造販売後調査変更申請書(別紙様式第2)を作成し、臨床研究支援センター治験部門を経由して病院長に提出しなければならない。
(製造販売後調査責任医師)
第9条 製造販売後調査責任医師は、次に掲げる要件を満たしていなければならない。
(1) 製造販売後調査を適正に行うことができる十分な教育及び訓練を受け、かつ、十分な臨床経験を有していること。
(2) 製造販売後調査実施計画書及び製造販売後調査依頼者から交付された製造販売後調査医薬品等の取扱い方法等に精通していること。
(3) 製造販売後調査を行うのに必要な時間的余裕を有していること。
2 製造販売後調査責任医師は、製造販売後調査分担医師に製造販売後調査の内容について十分に説明するとともに、副作用に関する情報その他分担させる業務を適正かつ円滑に行うために必要な情報を提供しなければならない。
3 製造販売後調査責任医師は、当該製造販売後調査の進行状況等について診療科等の長に適宜報告しなければならない。
4 製造販売後調査責任医師等は、出向等の理由により本院での製造販売後調査業務が遂行できない場合は、製造販売後調査変更申請書(別紙様式第2)により、他の医師に当該業務を引き継がなければならない。
(副作用報告)
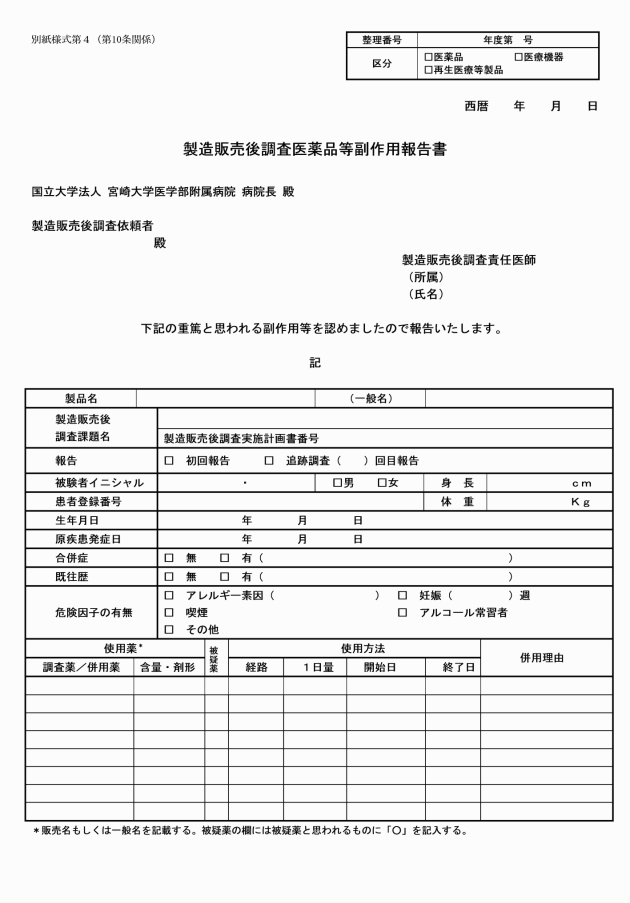
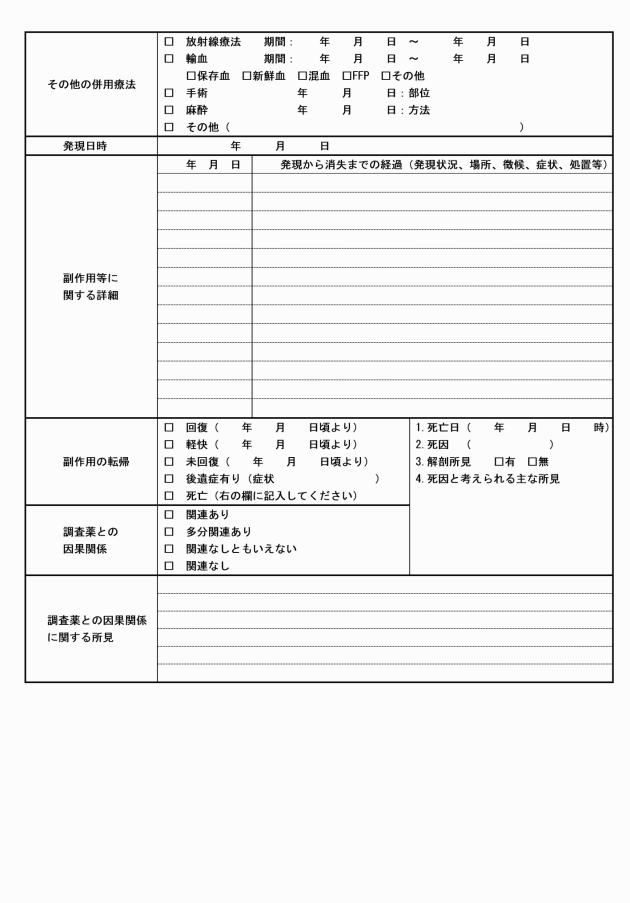
第10条 製造販売後調査責任医師は、製造販売後調査の実施中に重篤な副作用、その他有害事象が調査対象者に発生した場合には、直ちに適切な処置を行うとともに、製造販売後調査医薬品等副作用報告書(別紙様式第4)を病院長及び製造販売後調査依頼者に提出するものとする。
2 病院長は、製造販売後調査責任医師から前項の製造販売後調査医薬品等副作用報告書を受理した場合は、治験審査委員会にその内容を文書により報告の上で、当該製造販売後調査責任医師及び関連する診療科等の長に対し必要な指示を与えるものとする。
3 医療機器及び再生医療等製品においては、「副作用」を「不具合」に読み替えるものとする。
(実施状況報告)
第11条 製造販売後調査責任医師は、製造販売後調査が承認された年度内に終了しない場合には、当該年度末に製造販売後調査実施状況報告書(別紙様式第5)を診療科等の長に報告の上で、病院長に提出するものとする。
2 病院長は、前項の製造販売後調査実施状況報告書を受理した場合は、製造販売後調査の進行状況を確認するものとする。
(終了・中止報告)
第12条 製造販売後調査責任医師は、製造販売後調査を終了又は中止・中断した場合には、診療科等の長の合意の下、製造販売後調査終了(中止・中断)報告書(別紙様式第6)を病院長に提出するとともに、その報告書の写しを製造販売後調査依頼者に提出するものとする。
2 病院長は、製造販売後調査責任医師から前項の製造販売後調査終了(中止・中断)報告書を受理した場合は、治験審査委員会に報告の上で、製造販売後調査の終了又は中止を確認するものとする。
3 病院長は、製造販売後調査依頼者から製造販売後調査を中止する旨の通知があった場合には、その旨及びその理由等について製造販売後調査責任医師及び治験審査委員会に速やかに通知するものとする。この場合において、製造販売後調査責任医師は、治験審査委員会からの意見に基づき、調査対象者に対し必要な措置を講ずるものとする。
附則
この規程は、平成16年4月1日から施行する。
附則
この規程は、平成16年9月15日から施行する。
附則
この規程は、平成18年4月1日から施行する。
附則
この規程は、平成19年4月1日から施行する。
附則
この規程は、平成24年2月15日から施行する。
附則
この規程は、平成25年12月1日から施行する。
附則
この規程は、平成27年5月20日から施行し、平成27年4月1日から適用する。
附則
この規程は、平成29年1月18日から施行する。
附則
この規程は、平成30年12月1日から施行する。
附則
この規程は、令和元年9月18日から施行する。