細胞内のタンパク質の品質を管理する新しいメカニズムを発⾒ ⼩胞体ストレス依存的な翻訳抑制の分⼦機構の解明
2026年01月28日 掲載
細胞内のタンパク質の品質を管理する新しいメカニズムを発⾒
〜 ⼩胞体ストレス依存的な翻訳抑制の分⼦機構の解明 〜
宮崎⼤学の研究グループは、東京⼤学、⻘⼭学院⼤学、産業技術総合研究所との共同研究により、細胞がストレスを受けた際に、⼩胞体膜上で形成されるタンパク質複合体が、翻訳を制御することで、細胞質のタンパク質品質を保つ新たな仕組みを発⾒しました。本研究成果は、神経変性疾患や代謝性疾患など、タンパク質品質異常が関与する疾患の発症メカニズムの理解につながることが期待されます。
◆ 研究成果のポイント
● ⼩胞体ストレス依存的に形成されるタンパク質複合体(Derlins-Sec61β-ARIH1-4EHP)が、特定の分泌タンパク質の翻訳を抑制し、細胞質のタンパク質品質を維持する新機構を発⾒
● この翻訳制御システムの破綻により、プロテアソーム活性が低下し、細胞質において異常なタンパク質の凝集が⽣じ、運動機能が障害されることを解明
● 神経変性疾患や代謝性疾患などの、タンパク質品質異常が関与する疾患の新たな治療法開発につながる可能性
◆ 概要
細胞内のタンパク質の約3分の1は⼩胞体(注1)で合成され、正しく折畳まれた後に、細胞内外に輸送されて機能します。しかし、環境変化やタンパク質の過剰合成によって、⼩胞体内に正しい⽴体構造を取れない折畳み異常タンパク質が蓄積すると、「⼩胞体ストレス」と呼ばれる状態に陥ります。この状態が⻑く続くと細胞は死に⾄るため、細胞には異常タンパク質を修復・除去する品質管理機構が備わっています。
これまで研究グループは、⼩胞体品質管理機構の⼀つとして、⼩胞体膜タンパク質Derlins(注2)が、特定の分泌タンパク質の⼩胞体への膜透過を制限し、翻訳(注3)の場を⼩胞体から細胞質に変更した後、ユビキチン・プロテアソームシステム(注4)により速やかに分解する「翻訳時分解」機構を明らかにしてきました。これにより、⼩胞体内でのタンパク質合成負荷が軽減され、細胞はストレスから回復します。
今回、宮崎⼤学 医学部 機能⽣化学分野の⾨脇寿枝学部准教授、⻄頭英起教授らの研究グループは、東京⼤学、⻘⼭学院⼤学、産業技術総合研究所との共同研究により、これまで未解明であった翻訳時分解における「翻訳制御」の分⼦機構を解明しました。
本研究では、⼩胞体ストレス下において、⼩胞体膜上でDerlinsとトランスロコン構成因⼦Sec61β(注5)が結合し、さらにE3リガーゼARIH1(注6)および翻訳関連因⼦4EHP(注7)をリクルートしてタンパク質複合体を形成することを明らかにしました。
この複合体は、特定の分泌タンパク質の翻訳を選択的に抑制することで、細胞質での分解負荷を最⼩限に抑え、細胞質のタンパク質品質を維持します。この翻訳制御が破綻すると、タンパク質の過剰合成とプロテアソーム活性の低下が⽣じ、細胞質に異常な凝集タンパク質が蓄積し、最終的には個体レベルでの運動機能障害を引き起こすことが分かりました。本成果は、タンパク質品質異常により⽣じた凝集タンパク質が原因となる神経変性疾患や代謝性疾患などの発症メカニズムの理解を深め、将来的な治療戦略の開発につながることが期待されます。
本研究成果は、2026年1⽉27⽇付で、国際学術誌『EMBO Reports』(エンボリポーツ)電⼦版に掲載されました。
図1. 本研究成果の概略図
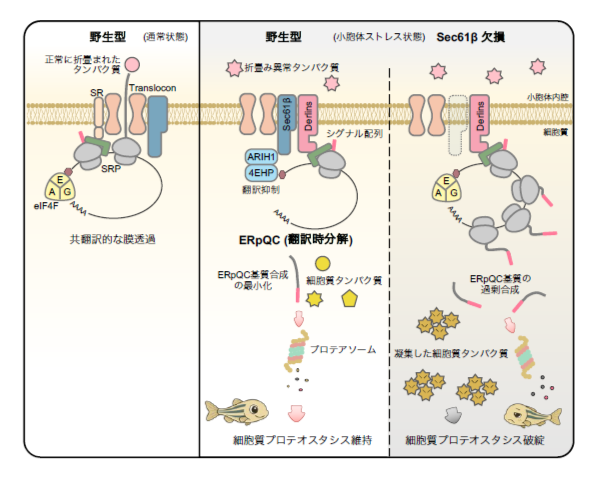
◆ 研究内容
1. 背景
私たちの体を構成する細胞では、常に多くのタンパク質が合成されています。そのうち約3 分の1 は、「⼩胞体」と呼ばれる細胞⼩器官(オルガネラ)で合成され、正しい⽴体構造に折畳まれた後、細胞外へ分泌されたり、細胞膜や細胞内のあらゆる場所へ輸送されたりすることで、はじめて機能を発揮します。しかし、細胞をとりまく様々な環境が変化したり、分泌タンパク質が過剰に合成されて折畳むべきタンパク質が増加したりすると、折畳みに失敗した異常タンパク質が⼩胞体内に蓄積し、「⼩胞体ストレス」と呼ばれる状態に陥ります。これらの異常タンパク質は正常に機能できないだけでなく、⼩胞体に⼤きな負担を与え、場合によっては細胞死を引き起こします。このような危機的状況を回避するため、細胞は「⼩胞体品質管理機構」を備えており、異常タンパク質の折畳みを修復したり、分解したりすることで⼩胞体の恒常性を維持しています。それと同時に、翻訳抑制やmRNA分解により⼩胞体で新たに合成されるタンパク質の量を減らすことで、折畳み作業の負荷を軽減します。しかし、すべてのタンパク質の合成を⽌めてしまうと、ストレス解消に必要な折畳みを⾏う分⼦(シャペロン)まで合成できなくなってしまいます。そのため、細胞は「必要なタンパク質だけを⼩胞体で合成し、不要なものの合成を選択的に抑制する」という、精密な制御を⾏う必要があります。
これまで研究グループは、⼩胞体ストレス状態にある細胞において、特定の分泌タンパク質が⼩胞体へ運ばれるのを防ぎ、合成の場を細胞質へと切り替え、翻訳完了後に速やかに分解される「翻訳時分解」の仕組み(ERpQC:ER stress‒induced pre-emptive quality control, ⼩胞体ストレス誘導性予防的品質管理)を発⾒しました(参考論⽂: Kadowaki et al. Cell Rep. 2015, Kadowaki et al. Sci. Rep. 2018, Kadowaki et al.FEBS J. 2019)。しかし、この仕組みが、細胞全体のタンパク質品質のバランスをどのように保っているのかは、これまで⼗分に解明されていませんでした。
2. 研究成果
本研究では、⼩胞体品質管理機構の⼀つであるERpQC において、「翻訳制御」に着⽬し、細胞質におけるタンパク質品質がどのように維持されているのか、その分⼦メカニズムの解明を⽬指しました。ERpQCは、「基質認識」「翻訳」「分解」の3つの過程から構成されます。まず「基質認識」に関わり、⼩胞体から細胞質へと特定の分泌タンパク質(ERpQC 基質)の合成場所を変更させる⼩胞体膜タンパク質Derlins に着⽬しました。⼩胞体ストレス依存的なDerlins の結合分⼦を探索した結果、トランスロコン構成因⼦Sec61βを同定しました。Sec61βはERpQC 基質の翻訳を選択的に抑制することが分かりました。次に、Sec61βがどのようにERpQC基質のみを選択的に翻訳抑制するのか明らかにするため、Sec61βの結合分⼦を探索したところ、E3リガーゼであるARIH1を同定しました。さらに、ARIH1の結合分⼦として知られる翻訳関連因⼦4EHPも含め、⼩胞体ストレス依存的にDerlins-Sec61β-ARIH1-4EHPからなる複合体が形成されることを⾒出しました。Sec61βと同様に、ARIH1および4EHPもERpQC基質の翻訳を抑制することが明らかになりました。興味深いことに、ARIH1はそのE3リガーゼ活性依存的にSec61βおよび4EHPと結合しており、E3リガーゼ活性を⽋くARIH1変異体では、ERpQC基質の翻訳が抑制されないことが分かりました。また、Sec61βによる翻訳抑制は、ARIH1 および4EHP との結合を介して⾏われており、ARIH1と結合できないSec61β変異体では翻訳抑制効果が失われることも確認されました。
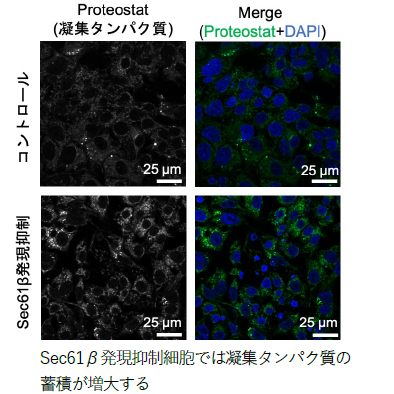
さらに、Sec61β-ARIH1-4EHP 軸による翻訳抑制の⽣理的意義を検討しました。Sec61β発現抑制細胞では、⼩胞体ストレス条件下でERpQC基質が過剰に合成されることから、細胞質におけるタンパク質分解への影響を調べたところ、プロテアソーム活性の低下が認められました。⼀⽅、ERpQC基質そのものの分解には影響がありませんでした。特筆すべきことに、Sec61β発現抑制細胞では細胞質に異常な凝集タンパク質が蓄積し(図2)、ARIH1と結合できないSec61β変異体では、野⽣型に⽐べて、この凝集タンパク質の蓄積抑制効果が弱いことが分かりました。さらに、ゼブラフィッシュを⽤いた個体レベルでの解析では、Sec61β発現抑制個体において体⻑の短縮や異常な遊泳⾏動が観察され(図3)、この表現型はARIH1のE3 リガーゼ活性に依存して回復することが明らかになりました。これらの結果から、⼩胞体ストレス依存的に形成されるDerlins-Sec61β-ARIH1-4EHP 複合体が、ERpQC 基質である特定の分泌タンパク質の翻訳を抑制することで、細胞質での分解負荷を軽減し、細胞質タンパク質の品質を維持していることが⽰されました。本研究は、⼩胞体膜上におけるストレス依存的な翻訳抑制という新たな分⼦メカニズムが、細胞全体のタンパク質品質の恒常性(プロテオスタシス)の維持に重要な役割を果たすことを明らかにした重要な発⾒です。
図2. ⼩胞体ストレス下での肝臓由来培養細胞内における凝集タンパク質 (緑)と核 (⻘)
3. 今後の展開
近年、アルツハイマー病や筋萎縮性側索硬化症(ALS)などの神経変性疾患、ならびに糖尿病などの代謝性疾患が、タンパク質品質異常により蓄積した凝集タンパク質によって引き起こされることが報告されています。本研究成果は、これらの疾患の発症メカニズムの理解を深めると同時に、細胞内で多くのタンパク質合成が⾏われる⼩胞体において、翻訳抑制を介して細胞全体のタンパク質品質を改善するという新たな治療戦略の基盤になることが期待されます。
◆ ⽤語説明
(注1) ⼩胞体:膜タンパク質や分泌タンパク質などの合成を担う細胞⼩器官(オルガネラ)。
(注2) Derlins:⼩胞体の品質管理に機能する⼩胞体膜タンパク質。哺乳類細胞ではDerlin-1, -2,-3から成るDerlinファミリーを構成する。
(注3) 翻訳:DNA から転写されたmRNA の塩基配列をもとに、リボソームがアミノ酸配列に変換して連結し、タンパク質を合成する過程。
(注4) ユビキチンプロテアソームシステム: 細胞内タンパク質に「ユビキチン」というタンパク質が付加(ユビキチン化)されることで分解標識となり、巨⼤なタンパク質分解装置である「プロテアソーム」によって分解される仕組み。
(注5) Sec61β:⼩胞体膜上に局在し、Sec61αおよびγとともに、タンパク質の膜透過を担うSec61トランスロコンを構成する因⼦。
(注6) ARIH1:RING-IBR (in-between-RING fingers)-RINGドメインを有するRBR型のユビキチン転移酵素(E3 リガーゼ)。ユビキチンまたはユビキチン様分⼦ISG15 を標的タンパク質に付加する。
(注7) 4EHP:翻訳開始因⼦eIF4Eの相同タンパク質(eIF4E2とも呼ばれる)。mRNAの5ʼ末端のキャップ構造に結合し、翻訳を抑制する。
図3. 受精後3⽇齢胚ゼブラフィッシュにおける尾部運動の重ね合わせ画像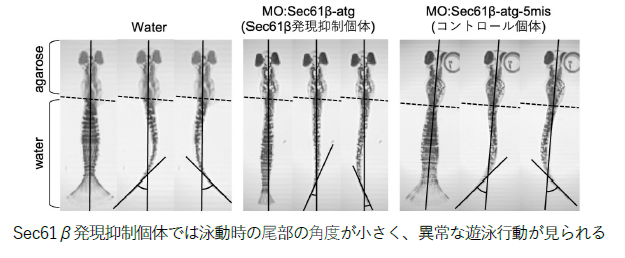
◆ 発表者
⾨脇 寿枝 (宮崎⼤学 医学部 機能⽣化学分野 学部准教授)
⼋⽥ 知久 (ロボティック・バイオロジー・インスティテュート株式会社 RSグループ・グループリーダー)
杉⼭ 和⾺ (宮崎⼤学 農学部 獣医学科 学部4年)
深⾕ 知広 (宮崎⼤学 医学部 免疫学分野 学部准教授)
藤澤 貴央 (東京⼤学⼤学院 薬学系研究科 細胞⽼化⽣物学教室 助教)
濵野 崇 (⻘⼭学院⼤学 理⼯学部 化学・⽣命科学科 修⼠1年)
村尾 直哉 (宮崎⼤学 医学部 機能⽣化学分野 助教)
⾼⾒ 恭成 (宮崎⼤学 医学部 機能⽣化学分野 准教授)
三苫 修也 (宮崎⼤学 医学部 免疫学分野 助教)
夏⽬ 徹 (産業技術総合研究所 ⽣命⼯学領域 ⾸席研究員)
佐藤 克明 (宮崎⼤学 医学部 免疫学分野 教授)
平⽥ 普三 (⻘⼭学院⼤学 理⼯学部 化学・⽣命科学科 教授)
上地 珠代 (宮崎⼤学 医学部 医学⽣物学分野 准教授)
⻄頭 英起 (宮崎⼤学 医学部 機能⽣化学分野 教授)
◆ 論⽂情報
雑誌名:「EMBO Reports」(2026年1⽉27⽇ オンライン公開)
論⽂タイトル:Sec61β maintains cytoplasmic proteostasis via ARIH1-mediated translational repression
upon ER stress
著者: *Hisae Kadowaki, Tomohisa Hatta, Kazuma Sugiyama, Tomohiro Fukaya, Takao Fujisawa, Takashi
Hamano, Naoya Murao, Yasunari Takami, Shuya Mitoma, Tohru Natsume, Katsuaki Sato, Hiromi Hirata,
Tamayo Uechi, *Hideki Nishitoh (*:責任著者)
DOI:10.1038/s44319-026-00690-y
URL:https://link.springer.com/article/10.1038/s44319-026-00690-y
◆ 特許出願
特願2024-197145「翻訳調節剤のスクリーニング⽅法及び翻訳調節剤のスクリーニングキット」
その他参考論文などの詳細はこちらから:https://www.miyazaki-u.ac.jp/public-relations/20260127_01_press.pdf
PDFファイルをご覧いただくためには、Adobe Reader(無償)が必要です。
Adobe Readerは
Adobe Readerのダウンロードページよりダウンロードできます。







